L’eau, c’est quoi ?

L'histoire d'H2O
L’homme n’a cessé de s’interroger sur la nature de l’eau. Pour Aristote (384-322 av. J.C.), l’eau avec le feu, la terre et l’air, fait partie des quatre éléments de la réalité universelle. À la même époque, Démocrite (460-370 av. J.C.) pense au contraire que la matière a une nature corpusculaire (le mot atome vient du grec atomos = indivisible). La théorie aristotélicienne est admise pendant deux mille ans. Mais, à la fin du XVIIIe siècle, tout est remis en cause. Le physicien anglais Cavendish réussit à démontrer en 1766 que l’eau était formée d’hydrogène puis Joseph Priestley découvre en 1774 l’oxygène. Le 27 juin 1783 en France, Lavoisier et Laplace réalisent la synthèse de l’eau à partir de 2 volumes d’hydrogène et d’un volume d’oxygène. En 1800, Anthony Carlisle et William Nicholson effectuent la première analyse de l’eau en y plongeant des fils de cuivre reliés à une pile (inventée cette année là par Volta). Ils récupèrent alors 2 volumes d’hydrogène et un volume d’oxygène. La formule chimique de l’eau est donc H2O. La recherche sur la structure de l’eau ouvre ainsi la voie à la chimie moderne
Seulement 3 atomes pour les plus grandes potentialités
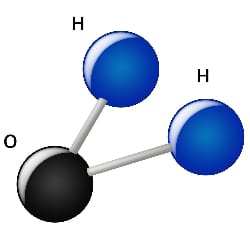
Celle-ci a une dimension de l’ordre d’un milliardième de mètre, soit un nanomètre (10-9). La molécule n’est pas une boule. Elle est constituée d’un atome d’oxygène relié à deux atomes d’hydrogène.
Sous une apparente simplicité, 3 atomes dont 2 d’hydrogène, l’eau cache des priorités d’une richesse exceptionnelle dues en particulier à sa structure spatiale.
Sa forme est celle d’un tétraèdre légèrement déformé, dans lequel les atomes dessinent une figure souvent surnommée la « tête de Mickey ». L’atome d’oxygène est placé au centre, les atomes d’hydrogène occupent deux des quatre sommets du tétraèdre, et les deux autres sommets sont occupés par des doublets non liants, c’est-à-dire des électrons qui ne participent pas à la liaison entre ces trois atomes.
Les trois états de l'eau
L’eau, sous l’action conjuguée de la chaleur et de la pression atmosphérique, change d’état, passant de celui de vapeur à l’état solide ou liquide.
L’état de vapeur (état gazeux)

L’eau évaporée va transiter dans l’atmosphère sous forme de vapeur invisible où elle reste pendant huit jours en moyenne. Puis l’eau va former des nuages qui vont retomber en pluie sur les continents et les océans. Le cycle de l’eau dans l’atmosphère sous forme de vapeur est assez court mais cependant vital car c’est la vapeur d’eau qui est à l’origine des 520 000 Km3 annuels de précipitations qui alimentent les réserves d’eau douce, que ce soit sous la forme de pluie, de neige ou de grêle, Par rapport à la masse totale de l’hydrosphère, la vapeur d’eau ne représente à la surface du globe qu’une toute petite quantité puisqu’elle est égale à 0,001 % de la totalité de l’eau.
L’état liquide

Le reste, c’est à dire l’eau salée, est contenu dans les mers et les océans. Ces derniers représentent 90 % de l’hydrosphère et couvrent plus de 71 % de la surface terrestre.
L’état solide

En fonction de l’altitude et de la température, les précipitations se font sous forme de neige ou de pluie. La neige est un stockage temporaire appelé à disparaître lors du redoux. Lorsque la température remonte, soit la neige retourne directement vers l’atmosphère par évaporation, c’est la sublimation, soit la fonte lente du manteau neigeux permet à l’eau de s’infiltrer dans le sol ou de ruisseler vers les rivières.
Les glaciers occupent actuellement 10 % des terres émergées. Ils sont surtout présents aux pôles. Les calottes glaciaires des pôles Nord et Sud sont les plus grands réservoirs d’eau douce de la planète. Les glaciers sont alimentés en surface par la neige. Ils ne sont pas immobiles mais s’écoulent lentement, emportés par leur propre poids, vers l’aval. Suivant le type de glaciers, leur vitesse de déplacement peut atteindre un mètre par jour ou par an. La masse des glaciers est très importante et, s’ils devaient fondre, le niveau des mers remonterait de près de 200 mètres.
La liaison hydrogène
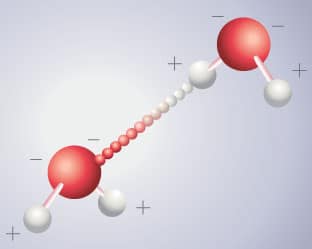
Chaque goutte d’eau contient plusieurs milliards de molécules d’eau, reliées les unes aux autres par leurs pôles, chargés électriquement : un pôle chargé négativement (l’atome d’oxygène) et un pôle chargé positivement (les atomes d’hydrogène).
En présence les unes des autres, les molécules vont se comporter comme de petits aimants : leurs pôles électriques positifs et négatifs s’attirent réciproquement et les molécules se rapprochent afin que chaque atome d’hydrogène (positif) de l’une se place près de l’oxygène (négatif) d’une voisine.
Les molécules d’eau sont alors liées par ce que l’on appelle une liaison hydrogène, cette liaison étant assurée par les atomes d’hydrogène. Ainsi, l’eau n’est pas un liquide ordinaire : au sein d’une même masse d’eau, la plupart des molécules sont liées entre elles en une sorte de réseau sans cesse changeant et modulable d’une fraction de seconde à l’autre.
En effet, si l’union à l’intérieur même d’une molécule, est très stable, il n’en est pas de même en ce qui concerne les liens entre les molécules. Ces dernières sont à la fois très proches et très libres, elles se lient entre elles et se défont tout aussi rapidement, elles « roulent » les unes sur les autres, changeant sans cesse leur ordonnancement. Cette liaison hydrogène est donc plus faible que celle qui soude entre eux les trois atomes de la molécule, mais cependant suffisamment forte pour expliquer les propriétés exceptionnelles de l’eau. Dans l’eau, les molécules H20 ont une telle attirance électrique les unes pour les autres qu’il arrive qu’un atome d’hydrogène de l’une soit capté par l’atome d’oxygène de l’autre.
Cet échange transforme les deux molécules H20 de départ en H30 et OH ; le nombre d’atomes et de charges électriques + et – n’est plus le même de chaque côté : d’un côté on trouve OH– et de l’autre H30+. Ces molécules modifiées s’appellent des ions et leurs propriétés s’annulent : l’eau est électriquement neutre.
Une représentation de la liaison hydrogène entre deux molécules d’eau. Dans l’eau, de nombreuses liaisons de ce type s’établissent entre les molécules. Elles sont à l’origine de certaines des propriétés très particulières de l’eau.
L’eau peut se former spontanément à partir de deux atomes d’hydrogène et d’un atome d’oxygène, mais seulement sous certaines conditions :
- Des quantités suffisantes d’oxygène et d’hydrogène,
- Une température pas trop élevée (pas plus de 2 000 à 3 000 °C)
- Un rayonnement ultraviolet pas trop important.
Or, ces conditions sont difficiles à réunir. En particulier, l’univers comporte 90 % d’hydrogène contre « seulement » 0,1 % d’oxygène. En l’état actuel de nos connaissances, la Terre est la seule planète du système solaire comprenant de l’eau liquide. Nous vivons donc bien sur la planète de l’eau… qui est aussi la planète de la vie.


